2023年7月21日,据国家药品监督管理局药品审评中心(CDE)官网显示,华夏源原研干细胞产品——“ELPIS人脐带间充质干细胞注射液”第五项适应症的临床试验申请(IND)获得受理(受理号:CXSL2300501)。
本次ELPIS产品是经CDE受理的华夏源第五个适应症为中、重度活动性炎症性肠病,属于自身免疫性疾病中较为常见的一类疾病,也进一步表明自身免疫性疾病领域是当前华夏源集团干细胞产品的主要应用方向。
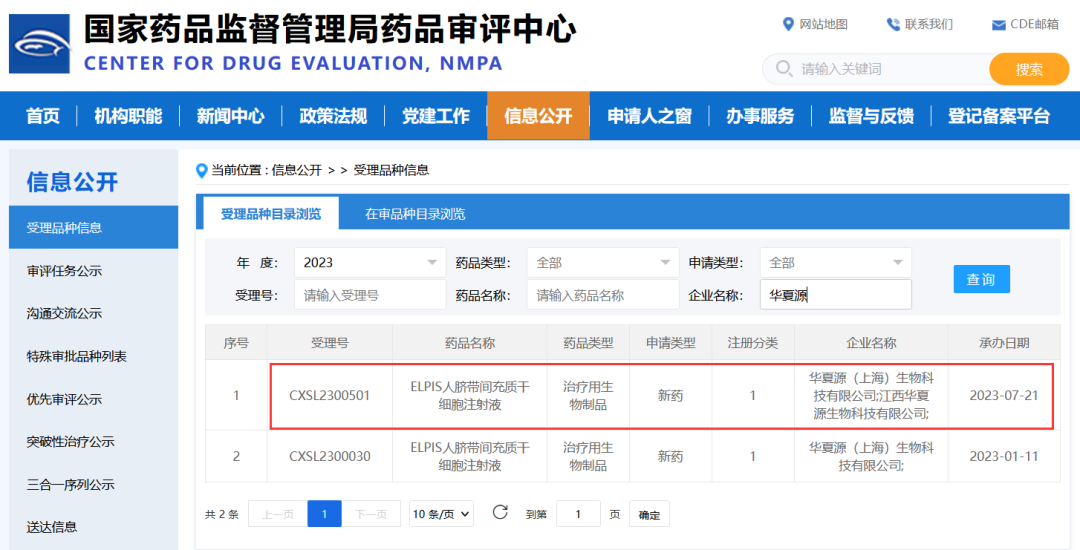
此前,这款干细胞新药申报的四个适应症,中、重度慢性斑块型银屑病、重度狼疮性肾炎、慢加急性(亚急性)肝衰竭和中、重度宫腔粘连均已获得开展新药临床试验默示许可。
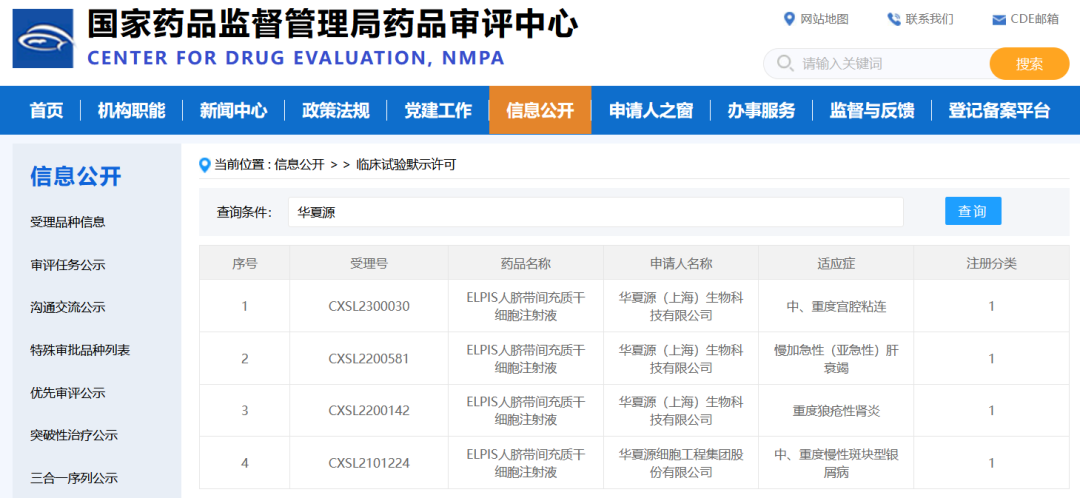
△截至目前,华夏源已有四款“ELPIS人脐带间充质干细胞注射液”产品适应症,获国家药监局药品审评中心(CDE)临床试验默示许可
CDE,即国家药品监督管理局药品审评中心,是国家食品药品监督管理局药品注册技术审评机构,按照国家食品药品监督管理局颁布的药品注册管理有关规章,负责组织对药品注册申请进行技术审评,组织开展相关的综合评审工作。
IND,即新药临床试验,是药物研发企业以注册目的,在药品正式上市前,向CDE提供足够信息来证明药品在人体进行试验是安全的,以及证明针对研究目的的临床方案设计是合理的而开展的人体临床试验。
炎症性肠病(Inflammatory bowel disease, IBD)是一类慢性非特异性肠道炎症性疾病,包括溃疡性结肠炎(Ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD)。其典型症状除腹痛和痉挛外,还包括血便、腹泻、频繁或紧急排便,甚至会伴随疲劳、食欲不振和体重减轻,严重影响患者的学习、工作和生活质量,且久治不愈可能导致癌变。
IBD的病因尚未完全明确,目前认为IBD是由遗传、肠道菌群紊乱、黏膜屏障损伤、免疫失调和环境等多因素相互作用引起的复杂性疾病。IBD的发生无明显的性别差异,可以发生在任何年龄段,但最常见于青少年和年轻人。根据中国疾病预防控制中心预测数据,我国2025年IBD患者将突破150万人。
IBD的治疗目标在于诱导并维持缓解以及黏膜愈合,防治并发症,改善生命质量。目前临床上常用的IBD传统治疗药物包括氨基水杨酸制剂、糖皮质激素、免疫抑制剂等。其中糖皮质激素和免疫抑制剂常作为中、重度IBD患者的一线治疗用药,但两者的副作用明显,长期或大量使用容易导致股骨头坏死、骨髓抑制等不良反应。
对于传统治疗无效、不能耐受以及糖皮质激素依赖的中、重度活动性IBD患者,可选择肿瘤坏死因子α(TNF-α)拮抗剂,然而,长期抗TNF治疗后可能增加发生淋巴瘤和机会性感染包括肺结核等严重不良反应的风险。因此对于中、重度IBD的治疗,发现和寻找其他不同作用机制的药物,有着巨大的需求和探索空间。
近年来,干细胞以其突出的免疫调节能力在自身免疫性疾病领域的大量研究及临床应用,为炎症性肠病提供了新的治疗思路。
此次“ELPIS人脐带间充质干细胞注射液”新增适应症由江西华夏源生物科技有限公司和华夏源(上海)生物科技有限公司作为联合申请人向CDE提出临床试验申请,其中江西华夏源生物科技有限公司主要承担了本品用于治疗中、重度活动性炎症性肠病的非临床药效学研究,而华夏源(上海)生物科技有限公司主要负责“ELPIS人脐带间充质干细胞注射液”的生产和质检放行工作。
结合体内外药效学研究发现本品对于炎症性肠病适应症具有强大的治疗潜能,它可以通过旁分泌大量的免疫调节因子、趋化因子和生长因子,调节体内失衡的免疫微环境重新恢复至稳态,同时促进肠上皮细胞的增殖,最终完成对肠黏膜屏障的修复,达到缓解疾病的作用。ELPIS人脐带间充质干细胞的这些作用特点决定了其治疗中、重度活动性炎症性肠病的优势。
华夏源将凭借丰富的报药经验,加快推进更多疾病新药申报,继续高质量地推动多个干细胞管线的临床转化,满足多种难治性疾病的治疗需求,让细胞科技惠及普罗大众。
免责声明:该文章系本站转载,旨在为读者提供更多信息资讯。所涉内容不构成投资、消费建议,仅供读者参考。

